11
خرداد
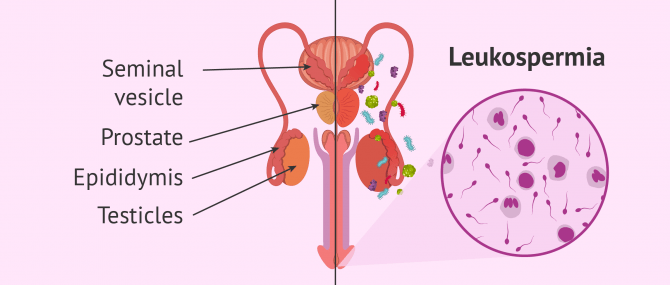
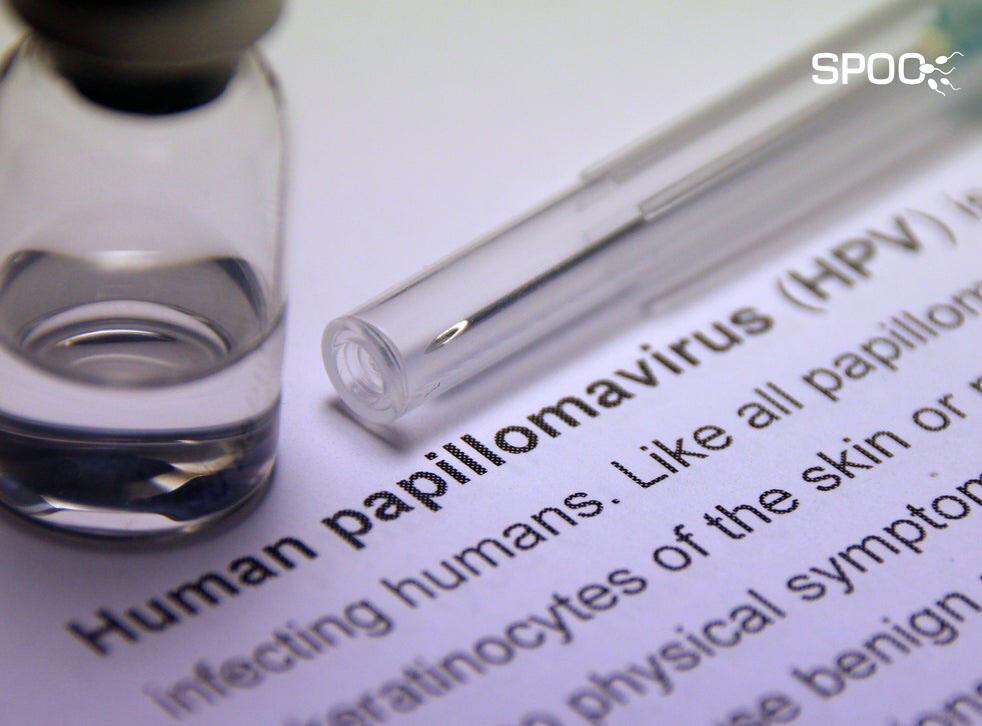
پاپیلوما ویروس انسانی و ناباروری مردان
مقدمهعلل ناباروری در مردانپاپیلوماویروس انسانیتحقیقات انجام شدهشیوع ویروسختنه و عفونت پاپیلوما ویروسیش...
11
خرداد
شکست DNA اسپرم و ناباروری در مردان
مقدمهعوامل اگزوژن و اندوژنی که باعث شکست DNA میگردد روش های درمانی شکست DNA اسپرممواردی که تست SDFA ...
10
خرداد
پروتامین اسپرم و ناباروری مردان
مقدمهعملکرد پروتامین هاتاثیر سیگار بر پروتامیناختلالات در اسپرماتوژنزعوامل موثر در آسیب DNAگلوبوزواسپرم...
09
خرداد
آیا میدانید افزایش سن بر کاهش قدرت باروری مردان موثر است؟
عباراتی مانند «عجله کنید پیش از آنکه دیر شود» اغلب برای ت...
08
خرداد
لولو و نانا نخستین نوزادان اصلاح شده ی ژنتیکی به دنیا آمدند!
در سال 2015، دانشمندان دانشگاه سان یات سن چین برای نخستین...
08
خرداد
تاثیر چاقی بر اختلالات اسپرم و ناباروری در مردان
چاقی یک وضعیت پزشکی است که در آن چربی اضافی بدن یا بافت چ...
07
خرداد
داروهای موثر بر قدرت باروری مردان
باروری یک مرد به کمیت و کیفیت اسپرم او بستگی دارد. اگر کمیت و کیفیت اسپرم ی...
06
خرداد
تاثیر مصرف قهوه و کافئین بر ناباروری در مردان
ناباروی و سبک غذایی
تقریبا ۱۳ درصد از افرادی که به سن بارور...
06
خرداد
آنتی بادی ضد اسپرم
مقدمهآنتی بادی ضد اسپرم و باروری مردانفرضیه های تشکیل آنتی اسپرم آنتی بادیپاتوژنز ناباروری به واسطه آنت...